免疫治疗出现以前,无EGFR/ALK敏感突变的晚期非鳞状非小细胞肺癌(NSCLC)患者的一线治疗主要是以含铂双药化疗为基础的治疗方案,在部分患者中可增加贝伐珠单抗。
Pembrolizumab横空出世,根据KEYNOTE-001的研究数据,Pembrolizumab单药治疗肺癌显示出比化疗更好的生存益处。TPS≥50%人群的5年生存率超过25%,但TPS<1%,1-49%人群并不及高标人群。
为了进一步提高Pembrolizumab的适用范围,科学家进行了不断改进。在KEYNOTE-189试验中,Pembrolizumab联合培美曲塞/铂类显著提高了晚期非鳞状NSCLC患者的OS、和ORR,且不需要考虑患者的PD-L1表达高低。2019年ESMOASIA大会上,KEYNOTE-407研究公布了中国亚组的分析数据,结果与全球分析一致,帕博利珠单抗联合卡铂/紫杉醇可为晚期鳞状NSCLC患者带来明显总生存期(OS)和无进展生存期(PFS)获益。因此,Pembrolizumab联合化疗在国内获批用于转移性NSCLC患者的一线治疗。

PD-1单药治疗受限于PD-L1的表达情况,在与化疗联合治疗后,可以不受PD-L1表达的影响。免疫联合治疗越来越受到欢迎,甚至成为一线治疗的方案。但科学家们似乎永远不满足于现状,追求更近一层楼,有没有什么方法能让疗效更上一层楼呢?
2022年7月20日,中国研究团队在国际权威期刊《ClinLungCancer》上发表一项Ⅰb临床研究,首次将CIK细胞免疫治疗联合PD-1抑制剂加化疗治疗肺癌,研究结果表明CIK细胞联合PD-1抑制剂和化疗在晚期NSCLC中具有良好的耐受性和令人鼓舞的疗效。

CIK细胞+PD-1+化疗
相辅相成强强联合
常规化疗可以介导肿瘤细胞对过继性T细胞转移的敏感性,化疗可以诱导肿瘤细胞自噬;另一方面,CIK细胞可以逆转化学抗性,使肺癌细胞对化疗药物重新敏感。
与预先存在的肿瘤浸润淋巴细胞相比,CIK细胞作为外来T细胞可能具有更强的杀伤肿瘤细胞的能力。CIK细胞可能在某种程度上将“冷”肿瘤转变为“热”肿瘤。
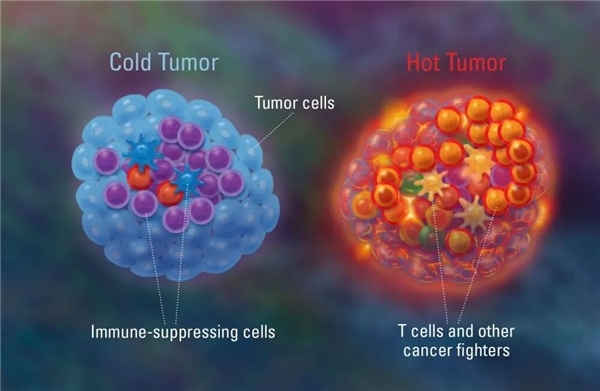
冷肿瘤和热肿瘤
这些发现表明,在化疗加PD-1抑制剂的基础上加入CIK细胞免疫疗法可以进一步提高疗效。
疾病控制率100%
客观缓解率82.4%
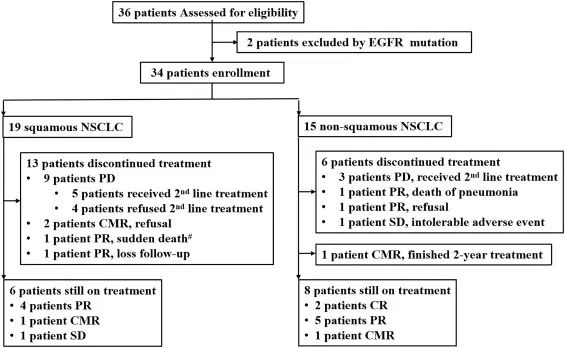
这是一项单中心、开放标签、1b期临床试验,共纳入34名IIIB/IIIC/IV期无EGFR/ALK/ROS1突变的鳞状或非鳞状NSCLC患者,其中19名患有鳞状NSCLC,15名患有非鳞状NSCLC,Ⅳ期28例(82.4%),其中脑转移3例,肝转移3例,骨转移7例。在32名患者中评估了PD-L1表达和CD8+TIL密度,15名(44.1%)患者的基线肿瘤PD-L1表达为1%或更高。患者接受Sintilimab(PD-1抑制剂)、卡铂、培美曲塞(非鳞状患者)或紫杉醇(鳞状患者)和自体CIK细胞。
治疗方案
到2021年8月31日,中位随访时间为14.4个月。在34名患者中,2名达到CR,5名CMR和21名PR。34名患者的客观缓解率(ORR)为82.4%,疾病控制率(DCR)为100%。在鳞状细胞癌和非鳞状细胞癌组中进行了亚组分析,在15个非鳞状细胞癌中的14个评估了客观反应,在19例鳞状细胞癌患者中有14例。3例脑转移患者中,2例达到CR和1例为SD。
截至截止日期,3例患者仍在持续缓解,无新患者发生脑转移。34例患者中有32例肿瘤缩小,其中15例(44.1%)肿瘤缩小超过50%。所有患者的中位PFS为19.3个月,非鳞状患者未达到,鳞状患者中位PFS分别为17.0个月。所有患者和非鳞癌患者的中位OS均未达到,鳞癌患者的中位OS为20.3个月。
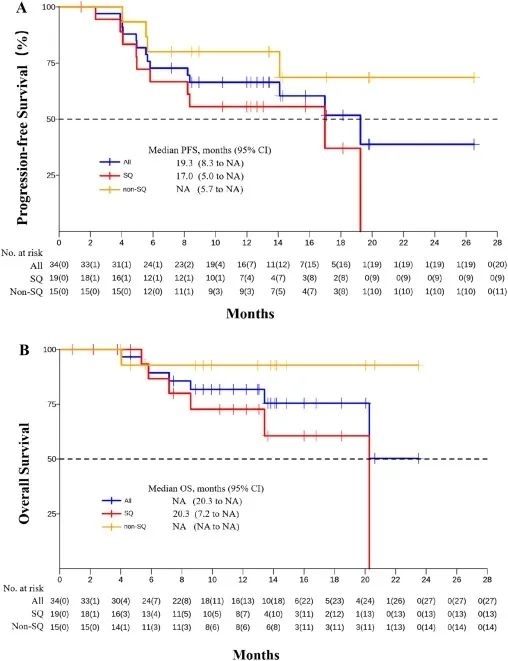
无进展生存期和总生存期
对比PD-1+化疗
CIK+PD-1+化疗,优势在哪?
安全性方面
在KEYNOTE-189、KEYNOTE-407、ORIENT-11和ORIENT-12的3期试验中,治疗相关的不良事件(TRAE)为98.2%至99.8%,3级或以上TRAE为61.7%至86.6%,免疫相关不良事件(irAE)为22.7%至48.5%,3级或以上irAE为5.6%至15.7%,导致死亡的TRAE为2.3%至10.8%。
在该试验中,TRAE、3级或以上TRAE、irAE、3级或以上irAE和导致死亡的TRAE分别为94.1%、64.7%、32.4%、11.8%和2.9%。
这些发现表明,在PD-1抑制剂加化疗中添加CIK细胞不会增加TRAE、irAE和死亡率。
ORR、中位PFS、中位OS变化
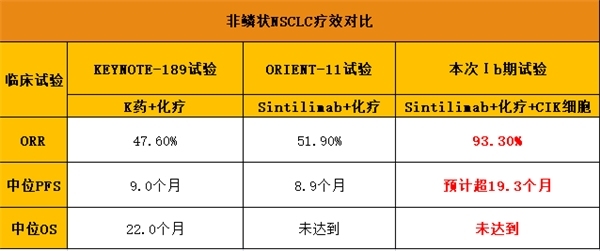
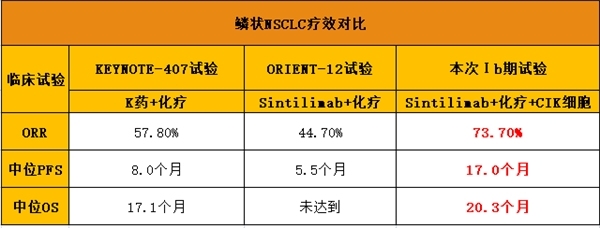
未达到:临床试验随访时间结束时,超过一半的患者还活着,说明试验结果超预期
从上述比较中可知,无论是鳞状患者还是非鳞状患者,在Sintilimab加化疗后增加CIK细胞,在ORR、中位PFS、中位OS上,相较PD-1加化疗,均提升了接近一倍的效果!
总之,这项1b期研究取得了令人鼓舞的疗效,为CIK细胞免疫疗法与PD-1抗体Sintilimab联合化疗在先前未治疗的晚期NSCLC患者中的安全性和有效性提供了证据。该项目由国家重点技术研发计划2018YFC1313400(夏建川)等支持,在肿瘤免疫治疗领域,中国研究也处于世界前列,期待越多医学研究惠及大众。
基于此优秀的数据,中国研究团队正在进行一项大样本、多中心随机化的2期试验,以进一步验证这些发现。(CCICC-002b ClinicalTrials.gov编号,NCT04836728)
参考文献:
1.A Phase IB Trial of Autologous Cytokine-Induced Killer Cells in Combination with Sintilimab, Monoclonal Antibody Against Programmed Cell Death-1, plus Chemotherapy in Patients with Advanced Non-Small-Cell Lung Cancer.Clin Lung Cancer.2022 Jul 21;S1525-7304(22)00153-X.
夏建川教授是国家重点研发项目的首席科学家,享受国务院政府特殊津贴专家。夏建川教授是医学博士、博士生导师,哈佛大学Dana-Farber肿瘤研究所博士后,现任中山大学附属肿瘤医院生物治疗中心主任、体细胞治疗与保健研究中心主任、亚太医学生物免疫学会主任委员,中国细胞治疗质量控制和研究专业委员会主任委员,中国生物治疗临床应用专业委员会副主任委员,中国医药生物技术协会常务理事,中国细胞学会常务理事,广东省细胞生物学学会理事长,广东省抗癌协会生物治疗专业委员会主任委员,国家食品和药品监督管理局新药评审专家,国家华南肿瘤学重点实验室免疫与遗传研究课题组组长;美国《CancerLetter》杂志编委,《癌症》杂志常务编委,国家自然基金和广东省自然基金重点项目评审专家。
夏建川教授团队长期从事肿瘤病因学和免疫治疗的基础与临床应用研究。在鼻咽癌、乳腺癌、胃癌、肠癌、肝癌和肾癌等恶性肿瘤的发病机制,以及肿瘤微环境、肿瘤干细胞及免疫细胞相互作用等方面做出了突破性工作。在国内率先建立了体细胞制备技术操作规范、体细胞临床应用安全检测标准和体细胞免疫治疗临床应用规范,为我国制定了第一个“自体免疫细胞(T细胞、NK细胞)治疗技术管理规范”,使体细胞免疫治疗向规范道路上迈出了重要的一步,为我国细胞免疫治疗在规范化的基础上开展临床应用做出了重要贡献。夏建川教授团队,依托中山大学肿瘤防治中心、华南肿瘤实验室的研究优势,肿瘤免疫细胞治疗临床研究及应用超过二十年,临床应用案例已超5万例次(数据截止2021年底),在国内乃至国际上遥遥领先。自主研发出一种新型抗肿瘤免疫细胞,PD1抗体激活的“功能增强型T细胞(PD1-T细胞)”,该细胞制备技术获得国家发明专利,有明显的创新性,为肿瘤患者的免疫细胞治疗开辟了一种新的治疗模式;基于肿瘤抗原和分子靶点与肿瘤预后的相关性,首次制定肿瘤患者免疫细胞纳入和疗效分子评估体系。
建立了六个免疫细胞治疗临床转化研究平台:1、建立靶向多种新型分子靶点的CAR-T/CAR-NK/TCR-T细胞治疗新技术及其临床转化研究平台;2、建立了“阻断”T细胞表面抑制性受体,PD1抗体激活的“功能增强型T细胞”治疗恶性肿瘤新技术及其临床转化研究平台;3、建立了半相合供者来源的肿瘤新抗原反应性T细胞治疗恶性肿瘤新技术及其临床转化研究平台;4、建立了自体细胞因子诱导的杀伤细胞和自然杀伤细胞标准制备工艺及其临床转化研究平台;5、建立了肿瘤浸润淋巴细胞制备标准工艺及其临床转化研究平台;6、建立慢病毒介导的基因修饰型免疫细胞标准制备工艺及其临床转化研究平台;为开展肿瘤免疫细胞治疗新技术的研发和临床转化应用奠定了坚实的基础。
声明:本文仅作健康科普,不能替代医院的检查和治疗。如有相关疾病,请及时去正规医疗机构就诊,谨遵医嘱。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。

咖啡,可谓是提神的好帮手,困了乏了来一杯,就能立马精神百倍。...[详细]
2024-07-03喝咖啡大大降低久坐死亡风险,尤其适合这4类慢病人群
一种名为 " 食人菌 " 感染症的疾病,正在日本快速蔓延。...[详细]
2024-07-01致命“食人菌”席卷日本,上千人感染!警告:可能传入国内
暑期来临,越来越多的家长带着孩子到口腔医院咨询牙齿矫正的相关事宜。近些年来,牙齿早期矫治逐渐成为备受关注的一个话题,家长对儿童牙齿早期矫治格外关注。...[详细]
2024-06-28儿童牙齿矫正:需密切关注但不过度干预
冬季儿童呼吸道疾病多发,其中流感病毒是常见的病原体之一。...[详细]
2024-12-27如何区分流感和普通感冒?儿科专家详解流感12个疑问
流言“‘最新研究发现:砂糖橘不能吃了’”今天微博一条关于“砂糖橘真的不能再吃了”的消息“炸”了,消息称,《自然》上有研究表明:果糖会促进肿瘤生长...[详细]
2024-12-25最新研究发现“砂糖橘不能再吃了”?真相……
在被别人猜中心思时,我们会说一句话:“你是我肚子里的蛔虫吗?”其实在几十年前,几乎每个中国人肚子里都有那么几条蛔虫。...[详细]
2024-12-25几十年前,人人肚子里几乎都有蛔虫,为何现在很少听说过了?
走路是最简单、最舒缓的运动,多走路对身体带来的好处数不胜数。...[详细]
2024-12-23走路时搭配这7个动作,益寿效果加倍!
刘阿姨和老伴儿两口子自己住,早饭一般都会选择在楼下遛弯玩儿后在小区门口的早餐店吃,她特别喜欢小区门口的包子馒头,又白又大又便宜。...[详细]
2024-12-23医生提醒:这4种食品才是最差的早餐
糖尿病是一种慢性疾病,影响全球超过5.4亿人。随着生活和饮食习惯的改变,糖尿病已经成为影响人类健康的第三大因素。...[详细]
2024-12-23研究发现:年轻时喝咖啡可以降低糖尿病风险
天冷之后,新鲜的水果总是“拔凉”,不少人吃了容易胃痛、腹泻。...[详细]
2024-12-20天冷了,这6种水果“加热吃”更营养!